Langganan:
Komentar (Atom)
BAHAN PRESENTASI UNTUK MATA KULIAH SISTEM DIGITAL TAHUN AJARAN SEMESTER GENAP 2020-2021 SISTEM DIGITAL B OLEH Tasya Rahmatika Nadrah 1910952...

-
BAHAN PRESENTASI UNTUK MATAKULIAH KIMIA TA SMT GANJIL 2019-2020 OLEH: Tasya Rahmatika Nadrah 1910952031 D...
-
BAHAN PRESENTASI UNTUK MATA KULIAH SENSOR TAHUN AJARAN SEMESTER GANJIL 2020-2021 SENSOR C OLEH Tasya Rahmatika Nadrah 1910952031 Dosen Peng...
















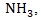












Tidak ada komentar:
Posting Komentar